注册登录才能更好的浏览或提问。
您需要 登录 才可以下载或查看,没有账号?立即注册
×
这是一个医院最近出的问题,现象是ADIVA60中间细胞过高,经过检查试剂和仪器没有问题,结果是抗凝剂引起的,浓度是2%的EDTA2K100ul烘干,血液采集量是50--100ul之间,这个比例将近超过标准10倍。去掉大部分抗凝剂后正常,对抗凝剂不做处理,标本静置时间延长也会降低中间细胞,这里说明一点的是wbc总数没有大的变化,下面是一个病人的标本,在cd3700上中间细胞为10。5(真空管,进口原装试剂和质控),镜检是10。3,在ADIVA60上,用2%100ulEDTA2K,采血量100ul,混匀后,静置10分钟的结果如下:
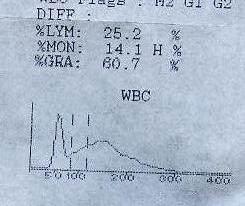 20分钟后结果如下:
20分钟后结果如下:
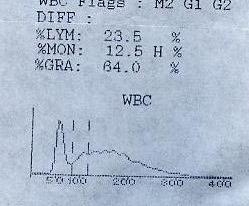 30分钟后结果如下:
30分钟后结果如下:
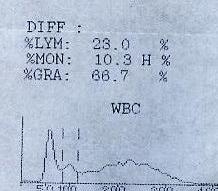 请注意图形的变化和数值的对应关系.这种现象好像只发生在固定界标的仪器上,对于浮动界标的仪器来说好像没有影响。
所以在这类仪器上都有关于标本采集静置时间的要求。
形成机理我说不清楚,因为我既不是搞检验的也不是搞细胞形态的,我只是一个电子工程师。但我可以用证据证明。这种试验我从99年起已经做过上百次了,在ABX,ABBOTT1700上非常的明显,首先要排出仪器和试剂的原因。大多故障出现在采指血而且是用离心管(小炮弹)的地方。抗凝剂多是自己添加的,而且烘干的抗凝剂尤为明显。仔细计算它们配制的比例就可以知道,这些配制远远大于每毫升血液1.5-2.2mg的抗凝剂比例,一般都要高出10倍甚至更多,有时候一瓶配制好的抗凝剂添加两次,第一次正常,相隔很久再添加第二批就会出现问题,原因大概是水分挥发造成浓度增高,或者加样疏忽造成的。这种情况经常发生,所以许多医院为了避免出现也是为了省事,干脆购买已经加好。
我的实验是这样做的,静脉采血3毫升,2毫升加入真空采血管(BD公司的),0.5毫升加入他们自制的离心管(0.5毫升的),0.2毫升;0.1毫升;0.08毫升分别加入自制的离心管中,,另外,将一只离心管的抗凝剂取出2/3后再加入0.08毫升的静脉血,同时充分混匀,静置15分钟后开始测试,每5分钟测试一遍,(这个时间短于仪器要求的时间,连续计数5次,也就是25分钟,观察中间细胞的变化。真空管在5次中没有变化,0.5毫升的也没有变化,0.2毫升的第一、二次是降低的态势,以后正常。0.1毫升和0.08毫升的每次都是降低态势,图形变化明显。取出部分抗凝剂的管子第一次和第二次图形不同而且数值也呈下降态势但以后三次都跟第二次一样,非常稳定。分析直方图,真空管和0.5毫升的管子做出来的图形很理想,其他四种图形的中间和中性图形过高压不下来,,特别是0.1毫升和0.08毫升的没有取出部分抗凝剂的,就像上面的图那样,而且没有足够的拉宽。造成这种现象的原因只能是抗凝剂,没有别的解释。当然配合镜检会更有说服力。但需要检验人员配合。作为维修人员我们的原则是找到问题所在,解决问题,并能给检验人员一个能够令他们信服的理由就算完成任务,至于机理除非是硬件或者软件本身的,否则我们无法作出合理的阐述,我们不是专家,我们只是为专家服务的。关于EDT2K对血液的影响有很多报道,都是针对PLT的,因为他们的阐述这个观点的时候举例仪器都是浮动界标的仪器,例如SYSMEX,MEK,等,但在ABBOTT和ABX,DANMA等固定界标的仪器对于分类的影响确是很大的,这也许是这两种界标之间的区别或者利弊吧,没有作更深的研究不好说,在5分类的仪器上却不会发生分类问题,主要集中在PLT上。
请注意图形的变化和数值的对应关系.这种现象好像只发生在固定界标的仪器上,对于浮动界标的仪器来说好像没有影响。
所以在这类仪器上都有关于标本采集静置时间的要求。
形成机理我说不清楚,因为我既不是搞检验的也不是搞细胞形态的,我只是一个电子工程师。但我可以用证据证明。这种试验我从99年起已经做过上百次了,在ABX,ABBOTT1700上非常的明显,首先要排出仪器和试剂的原因。大多故障出现在采指血而且是用离心管(小炮弹)的地方。抗凝剂多是自己添加的,而且烘干的抗凝剂尤为明显。仔细计算它们配制的比例就可以知道,这些配制远远大于每毫升血液1.5-2.2mg的抗凝剂比例,一般都要高出10倍甚至更多,有时候一瓶配制好的抗凝剂添加两次,第一次正常,相隔很久再添加第二批就会出现问题,原因大概是水分挥发造成浓度增高,或者加样疏忽造成的。这种情况经常发生,所以许多医院为了避免出现也是为了省事,干脆购买已经加好。
我的实验是这样做的,静脉采血3毫升,2毫升加入真空采血管(BD公司的),0.5毫升加入他们自制的离心管(0.5毫升的),0.2毫升;0.1毫升;0.08毫升分别加入自制的离心管中,,另外,将一只离心管的抗凝剂取出2/3后再加入0.08毫升的静脉血,同时充分混匀,静置15分钟后开始测试,每5分钟测试一遍,(这个时间短于仪器要求的时间,连续计数5次,也就是25分钟,观察中间细胞的变化。真空管在5次中没有变化,0.5毫升的也没有变化,0.2毫升的第一、二次是降低的态势,以后正常。0.1毫升和0.08毫升的每次都是降低态势,图形变化明显。取出部分抗凝剂的管子第一次和第二次图形不同而且数值也呈下降态势但以后三次都跟第二次一样,非常稳定。分析直方图,真空管和0.5毫升的管子做出来的图形很理想,其他四种图形的中间和中性图形过高压不下来,,特别是0.1毫升和0.08毫升的没有取出部分抗凝剂的,就像上面的图那样,而且没有足够的拉宽。造成这种现象的原因只能是抗凝剂,没有别的解释。当然配合镜检会更有说服力。但需要检验人员配合。作为维修人员我们的原则是找到问题所在,解决问题,并能给检验人员一个能够令他们信服的理由就算完成任务,至于机理除非是硬件或者软件本身的,否则我们无法作出合理的阐述,我们不是专家,我们只是为专家服务的。关于EDT2K对血液的影响有很多报道,都是针对PLT的,因为他们的阐述这个观点的时候举例仪器都是浮动界标的仪器,例如SYSMEX,MEK,等,但在ABBOTT和ABX,DANMA等固定界标的仪器对于分类的影响确是很大的,这也许是这两种界标之间的区别或者利弊吧,没有作更深的研究不好说,在5分类的仪器上却不会发生分类问题,主要集中在PLT上。
[此贴子已经被作者于2005-4-5 19:19:46编辑过]
|