注册登录才能更好的浏览或提问。
您需要 登录 才可以下载或查看,没有账号?立即注册
×
流式细胞术的最新突破
摘要: 随着现代科技的高速发展,为了满足生命科学对细胞分析更高层次的要求,流式细胞技术仍然在快速发展,并已经在检测技术、分选技术及高通量分析等方面取得了许多突破。本文就流式细胞术的最新进展做一些介绍。
流式细胞术(Flow Cytometry,FCM)是一种对液流中排成单列的细胞或其它生物微粒(如微球,细菌,小型模式生物等)逐个进行快速定量分析和分选的技术。作为应用流式细胞术进行检测的技术平台,现代流式细胞仪产生于上世纪六七十年代。经过近四十年的发展和完善,今天的流式细胞仪已经十分成熟,并被广泛的运用于从基础研究到临床实践的各个方面,涵盖了细胞生物学、免疫学、血液学、肿瘤学、药理学、遗传学及临床检验等领域,在各学科中发挥着重要的作用。
现代流式细胞术综合了流体力学技术、激光技术、电子物理技术、光电测量技术、计算机技术、荧光化学技术及单克隆抗体技术,是多学科多领域技术进步的结晶。随着现代科技的高速发展,为了满足生命科学对细胞分析更高层次的要求,流式细胞技术仍然在快速发展,并已经在检测技术、分选技术及高通量分析等方面取得了许多突破。本文就流式细胞术的最新进展做一些介绍。
一、流式细胞检测与细胞成像的结合
使用传统的流式细胞检测技术,研究人员可以分析成千上万个细胞,获得每个细胞的散射光信号和荧光信号的数值,从而得到细胞群体的各种统计数据,并可以找到稀有的细胞亚群。但是传统流式细胞检测技术仍然存在局限,那就是获得的细胞信息很有限。细胞对研究人员来说,只是散点图上的一个点,而不是真实的细胞图像,缺乏细胞形态学、细胞结构及亚细胞水平信号分布的相关信息。要想获得细胞图像,研究人员就必须使用显微镜进行观察,但显微镜能够观察的细胞数量是非常有限的,很难提供细胞群体的量化与统计数据。因此,使用传统的细胞分析技术,我们就只能面对这样的两难选择,没有一种技术可以既提供细胞群体的统计数据,又获得细胞图像。不过,最近美国Amnis公司推出的ImageStream成像流式细胞仪,给传统细胞分析带来突破性的变革。
ImageStream是一种台式多谱段成像流式细胞仪(Multispectral Imaging Flow Cytometry),能够同时采集6个检测通道中的细胞图像(图1)。它将流式细胞检测与荧光显微成像结合于一身,既能提供细胞群的统计数据,又可以获得单个细胞的图像,从而提供细胞形态学、细胞结构和亚细胞信号分布的信息。
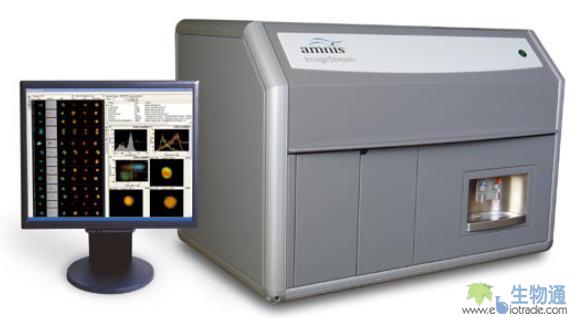
图1. ImageStream流式细胞成像系统
与传统流式细胞仪很类似,ImageStream也是由液流系统,光学系统和电子系统等三大部分组成。液流系统将样本细胞悬液和系统鞘液注入流动室中,使细胞在鞘液流的约束下聚焦在液流的中心,逐个流过检测窗口。光学系统中光源照射通过检测窗口的细胞,从而产生光信号。光源分为两种,其一是用于产生明场细胞图像的卤灯(Brightfield Illuminator),另一种是用于产生荧光细胞图像的激光器。光源照射细胞产生的光信号被具有很大数值孔径(NA:0.75)的物镜收集,然后通过光路系统传递到由二向色镜构成的滤光片堆栈(Dichroic Filter Stack),光信号在这里被分成不同波段投射到一个六通道冷CCD上,产生一个明场细胞图像,一个暗场细胞图像(Side Scatter,SSC)及四个不同荧光通道的细胞图像。ImageStream的光路系统能够自动调整焦距,并实时测定细胞运动速度,而其冷CCD采用时间延迟积分方式(Time Delay Integration,TDI)进行信号采集,上述这些手段保证了系统采集到的细胞图像的质量。
ImageStream系统配有功能强大的数据分析软件IDEAS(图2),可以对每个细胞分析超过500种量化参数。这些参数不仅包括细胞整体的散射光和荧光信号强度,还包括对细胞形态,细胞结构及亚细胞信号分布的分析。通过在细胞群体中对这些参数进行统计,分析软件可以生成细胞群体的散点图和柱状图,而这些统计数据与细胞图像是完全整合的,比如点击散点图上的点,就可以直观的看到这个点代表的细胞的图像。另外,使用者还能够根据自身研究的特殊需要,进行自定义参数的设定,进行更深入的分析。
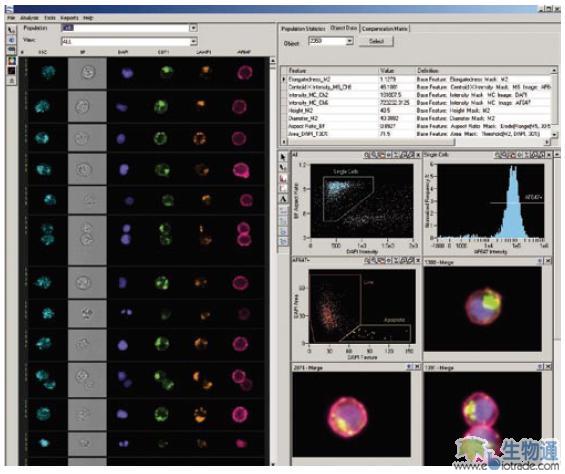
图2. IDEAS分析软件
ImageStream流式细胞成像系统结合了流式细胞检测功能与荧光显微成像功能,并整合了功能强大的分析软件,几乎可应用于细胞分析的所有领域,大大深化和拓展了流式细胞术的应用。下面简要列举一些ImageStream的新颖应用。
1. 细胞信号转导/通路分析 (Cell Signaling/ Pathway Analysis)
细胞信号通路中关键因子的磷酸化水平和在细胞内的分布是细胞信号转导研究的重要内容。ImageStream系统结合流式细胞术与荧光显微成像的检测方式,一方面可以统计细胞内因子的磷酸化程度,一方面可以通过分析细胞图像来确定信号因子在亚细胞水平定位的变化,因而非常适合进行这方面的研究。
转录因子从细胞质转移到细胞核(Nuclear Translocation)是细胞信号转导的重要事件。传统的检测方法是使用荧光显微镜进行观察,但是这种方法效率很低,所能观察的细胞数量十分有限,且很难对不同细胞的转位程度进行评估。为了更有效的检测Nuclear Translocation,ImageStream系统在IDEAS分析软件中引入了一个全新的参数—Similarity,来对采集的细胞图像进行分析。所谓Similarity,是指两个不同荧光检测通道采集的荧光图像在空间分布上的一致性(图3)。Similarity值越高,则两张细胞图像上的信号分布越相似。对于Nuclear Translocation研究来说,Similarity值越高,细胞因子转位的程度就越高。
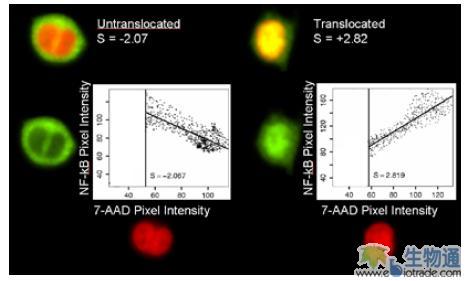
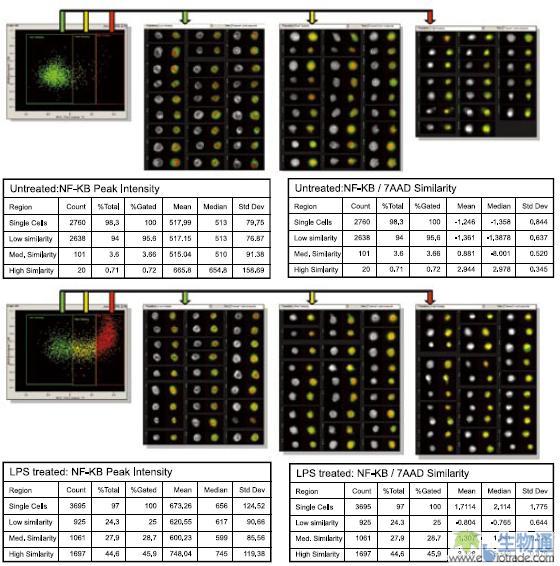
NF-κB是一类重要的转录因子,能够在多种组织中激活不同基因的表达,与慢性和急性炎症,自身免疫性疾病及多种癌症的发生存在着联系。脂多糖(LPS)能够激活人类单核细胞系THP-1的一个信号通路,导致NF-κB的转位。研究人员使用LPS处理细胞,Alexa Fluor 488标记的抗NF-κB抗体和7-AAD染色细胞,利用ImageStream进行检测。在散点图上以一定的Siminlarity值设门,定量分析NF-κB转位的细胞亚群所占比例,然后通过观察细胞图像,确认结果的准确性。分析显示,LPS处理后,细胞内的NF-κB发生了明显的转位,细胞群体的Median Similarity值由-1.358变为2.114,发生高度转位的细胞比例从0.72%增加到45.9%(图4)。
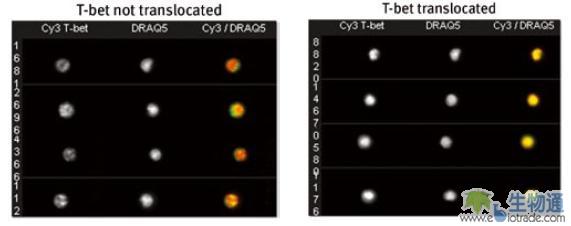
T-bet是属于T-box家族的新型转录因子,选择性地表达于Th1细胞。研究人员利用ImageStream系统研究了这种T细胞特异性转录因子的转位情况。从T-bet敲除小鼠的脾脏和淋巴结中分离的CD4阳性细胞被转染了带有T-bet基因和GFP报告基因的质粒。T-bet位于激素诱导启动子(Estrogen receptor promoter, ER)的下游。实验采用他莫昔芬(Tamoxifen)处理细胞,观察T-bet转位的情况。T-bet用Cy3标记,细胞核用DRAQ5染色,在柱状图上设R4门,通过观察门内和门外的细胞图像,确定设门位置为Similarity值大于1.8。结果显示,他莫昔芬处理后,细胞中的T-bet转核程度有了显著的增加,发生T-bet转核的细胞百分比从22.7增加到57.9(图5)。
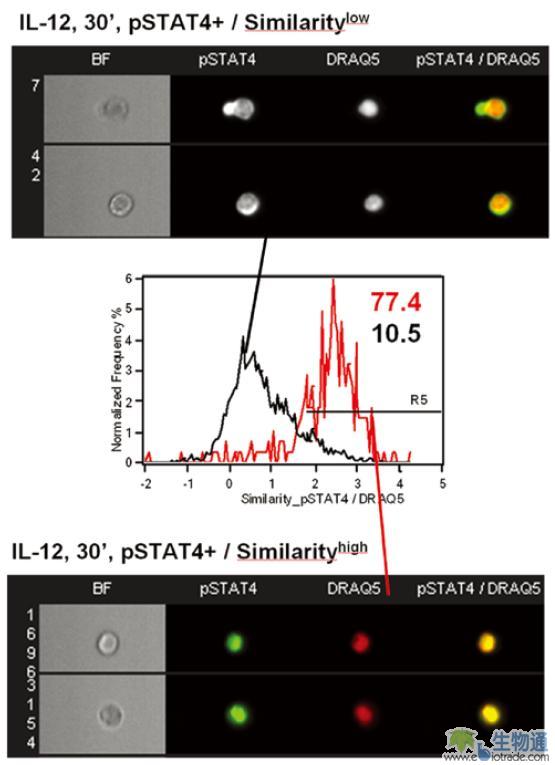
细胞因子可以诱导CD4阳性细胞内相关信号通路的激活,导致STAT4(signal transducer and activator of transcription 4)的磷酸化和向细胞核内转移。研究人员用IL-12处理人外周血单核细胞(PBMC),然后用抗pSTAT4和CD4的抗体及DRAQ5染色,利用ImageStream检测pSTAT4的转位。结果表明,IL-12处理半小时后,pSTAT4发生了明显的向细胞核内的转移(图6)。
2. 细胞间相互作用(Analysis of Cell Conjugates)
细胞间的相互作用是通过细胞膜相互接触部位上的分子相互作用来实现的。研究细胞间相互作用,不仅要找到细胞双联体,还要对两个细胞接触部位的信号分子的分布进行研究。T细胞与抗原递呈细胞(APC)之间的相互作用,作为T细胞活化过程的重要部分,是研究细胞间相互作用的一个很好范例。
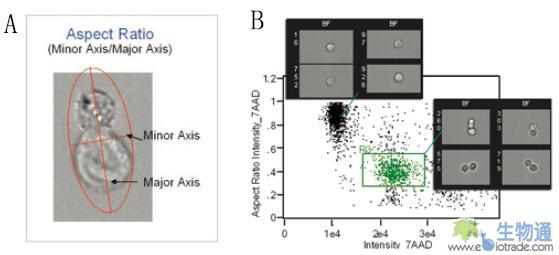
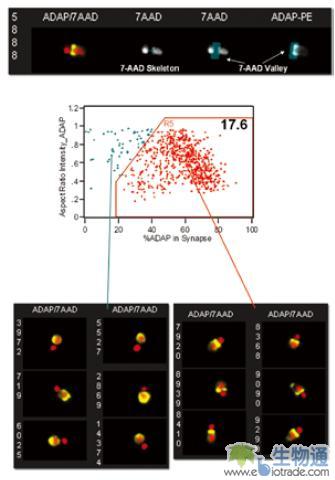
在这个实验中,研究人员使用一种D011.10 TCR转基因小鼠淋巴结中分离的OVA多肽特异性T细胞与OVA多肽致敏APC进行研究。实验的第一步是寻找两种细胞的双联体。首先利用针对T细胞特异性标记Thy1.1和T细胞受体(TCR)信号通路关键因子ADAP(Adhesion and Degranulation promoting Adaptor Protein)的抗体和细胞核染料7-AAD染色细胞。然后利用ImageStream检测样品。在散点图上设门,找到Thy1.1和ADAP双阳性的T细胞,然后在这些细胞中寻找细胞双联体。IDEAS分析软件提供了Aspect Ratio参数,即细胞横纵轴长度之比,来区分不同形态的细胞(图7. A)。散点图中具有更高的7-AAD信号和较小Aspect Ratio值的群体就是细胞双联体(图7. B)。
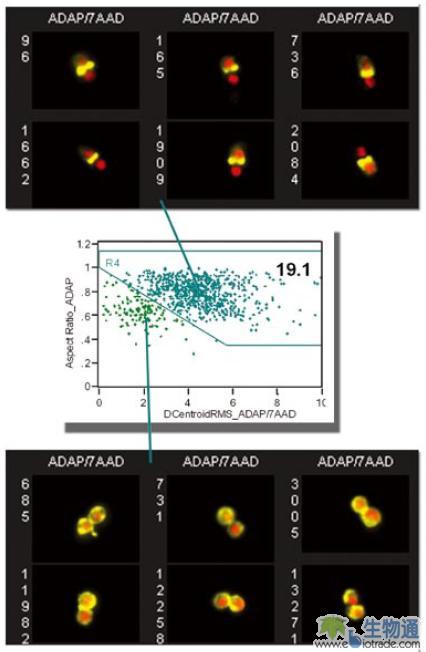
由于是在T细胞群基础上寻找细胞双联体,所以得到的双联体中不仅有T细胞和APC的双联体,也有两个T细胞组成的双联体,因此还需要做进一步分析。利用IDEAS分析软件提供的Delta Centroid参数,即两个荧光图像中心之间的距离,可以方便的区分上述两种双联体(图8. A)。如果双联体上都是T细胞,两者都表达ADAP分子,那么ADAP信号的中心与细胞核信号中心之间的距离就很近;如果双联体由T细胞和APC构成,其中只有T细胞表达ADAP,因此ADAP信号的中心与细胞核信号中心之间的距离就比较远。图8. B中编号为7058的双联体就是两个T细胞组成的,ADAP和7-AAD代表的细胞核之间的Delta Centroid只有2个象素,而编号5527的双联体由T细胞和APC组成,ADAP和细胞核之间的Delta Centroid达到7.1个象素。

这样,研究人员就可以在散点图上设门,通过观察细胞图像来确认设门的准确性。图中右上方的细胞群,也就是ADAP和细胞核之间的Delta Centroid值和ADAP的Aspect Ratio值都较大的细胞群就是T细胞和APC结合的双联体,占总细胞群体的19.1%(图9)。T细胞与APC之间要产生相互作用,除了需要形成细胞双联体,还要有信号分子在细胞结合部位富集,以形成免疫突触(Immune Synapse)。通过软件分析两个细胞结合部位的ADAP信号占整个细胞ADAP信号的比例,以及ADAP的Aspect Ratio值,研究人员找到了已经形成免疫突触的T细胞与APC双联体,其比例约占整个细胞群体的17.6%(图10)。
3 . 分子共定位与胞内分子转运(Analysis of Molecular Colocalization and Intracellular Molecular Trafficking)
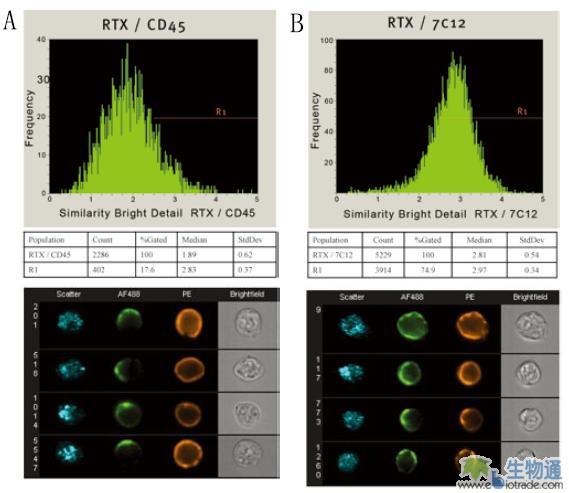
治疗性抗体在细胞内的作用位点是分子共定位研究的一个重要方面。研究人员利用ImageStream研究了一种抗肿瘤治疗型单抗“利妥昔”(Rituximab,RTX)的作用机制。前人的研究表明,RTX能与CD20特异性结合,其抗肿瘤活性与补体依赖型细胞毒性(Complement-dependent cytotoxicity,CDC)有关。
本实验中,从慢性淋巴细胞性白血病病人血液中分离的B细胞与AF488标记的RTX孵育,然后分别被PE标记的抗补体C3b的抗体(7C12)和作为阴性对照的抗CD45的抗体染色。经ImageStream的检测,通过Similarity参数进行分析,结果显示,RTX与CD45没有分布上的一致性(图11.A),而与C3b具有明显的共定位特征(图11.B),表明RTX与CD20阳性细胞的结合可能激活了补体信号通路,并导致C3b补体在RTX结合处富集,从而形成共定位。
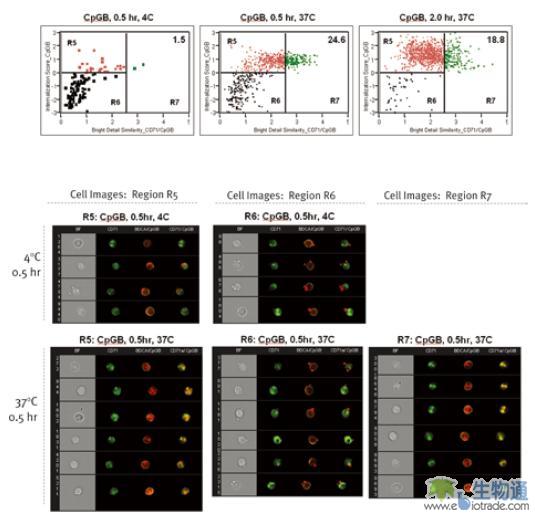
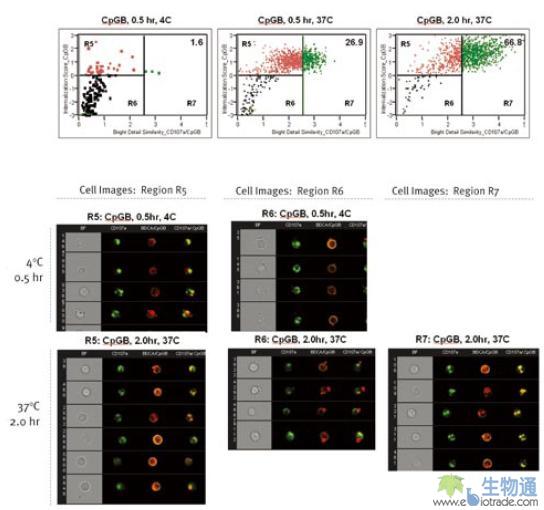
人血液树枝状细胞(plasmacytoid dendritic cells,pDC)是免疫系统病毒响应的重要部分。虽然它只占外周血细胞的0.2%不到,但却在HSV响应中发挥重要作用。相关研究人员利用ImageStream对病毒响应过程中pDC细胞对病毒碎片的内摄(Internalization)和胞内转运进行了研究。本实验中,将从人外周血中分离的pDC细胞与CpGB分别在4℃和37℃进行孵育,然后使用PE标记的抗pDC细胞标记BDCA的抗体和FITC标记抗内涵体标记CD71或抗溶酶体标记CD107a的抗体对细胞进行染色,最后用ImageStream进行检测。利用散点图上设门找到BDCA阳性的pDC细胞群,然后分析CpGB的Internalization参数,及其与CD71和CD107a的Similarity参数,生成散点图。所谓CpGB的Internalization参数,指细胞内部CpGB的信号占总的CpGB信号的比例。结果显示,4℃孵育会抑制CpGB的内摄。37℃孵育0.5小时后,在24.6%的pDC细胞中,CpGB定位于内涵体;37℃孵育2小时后,在18.8%的pDC细胞中,CpGB定位于内涵体(图12. A)。37℃孵育0.5小时后,在26.9%的pDC细胞中,CpGB定位于溶酶体;37℃孵育2小时后,在66.8%的pDC细胞中,CpGB定位于溶酶体(图12.B)。这说明CpGB被pDC细胞内摄后,首先进入内涵体,然后被转运到溶酶体中。
4. 细胞形态学(Quantitative Morphology)
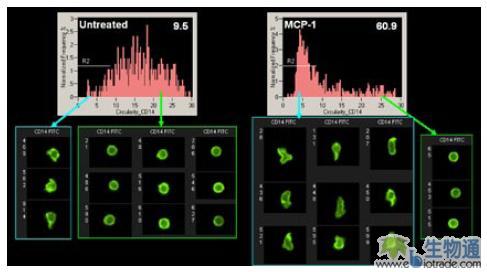
细胞形态的改变是免疫响应的一个方面。当病原体侵入机体后,首先被入侵的细胞会释放出一些化学信号,诱导免疫细胞发生形变,并向病原体入侵的部位移动。一些研究人员研究了化学诱导物MCP-1引发的细胞变形。该实验采用FITC标记的抗CD14抗体染色细胞,然后用ImageStream检测。利用Circularity参数对CD14阳性细胞群体进行分析。所谓Circularity参数,是指细胞平均半径比上细胞半径的变量。结果显示,MCP-1处理后,变形的细胞从9.5%增加到60.9%(图13.)。
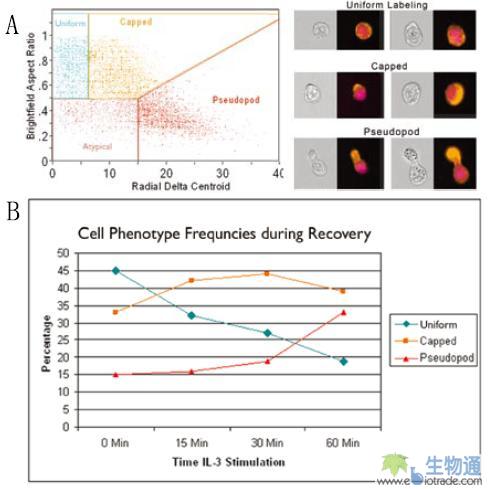
伪足形成实验也是细胞形态研究的一个领域。相关研究人员对一个IL-3依赖性细胞系在IL-3饥饿3小时后重新供给IL-3,观察细胞伪足形成的情况。细胞被PE标记的抗伪足标记分子Podo的抗体和DRAQ5染色,然后用ImageStream进行检测。利用上述的Aspect Ratio和Delta Centroid参数绘制散点图,将伪足形成过程中的细胞分成Uniform、Capped及Pseudopod等三类(图14.A)。结果显示,随着IL-3孵育时间的延长,Uniform细胞逐渐减少,而形成伪足的细胞逐渐增加(图14.B)。
5. 荧光原位杂交(FISH In Suspension)
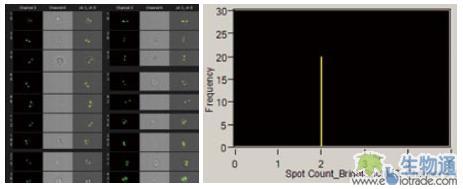
通过使用ImageStream,高通量FISH可以应用到悬浮细胞中。相关研究人员利用12号染色体的一个探针与人外周血单核细胞进行杂交,利用IDEAS软件进行自动数点分析,结果显示了该位点在遗传上非常稳定(图15.)。
6. 基因表达分析(Gene Expression Analysis)
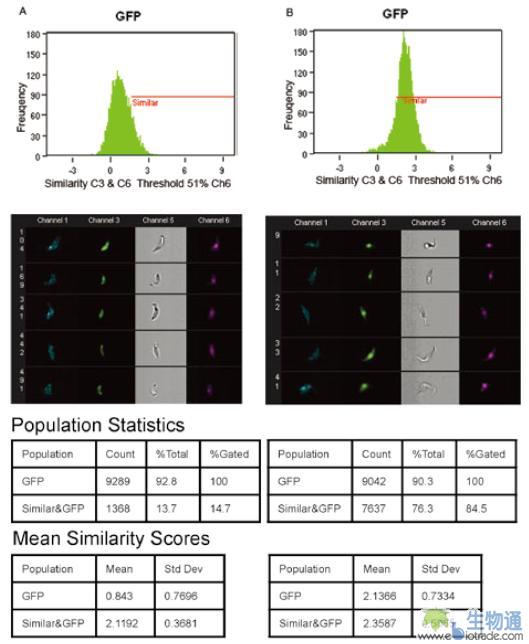
绿色荧光蛋白(GFP)是用于基因表达分析的常用标记。锥形虫(Trypanosome)是一种与多种人类疾病相关的单细胞病原体。相关研究人员利用GFP研究了两种基因P19和NP19在锥形虫体内的表达情况。该实验中,锥形虫分别被P19-GFP和NP19-GFP转染,然后用DRAQ5染色,在ImageStream上进行检测,其中GFP在通道3(Ch3)检测,DRAQ5在通道6(Ch6)检测。分析时,首先在散点图上找到GFP阳性的细胞群,然后利用Similarity参数分析GFP信号分布与细胞核的相似度,结果显示,转染NP19-GFP的细胞,平均的Similarity值达到2.1366,在84.5%的细胞中GFP信号定位于细胞核(图16. B),而转染P19-GFP的细胞,这两项数值分别为0.843和14.7%(图16. A)。这个结果表明,P19蛋白定位于细胞质,而NP19定位于细胞核。
7. 细胞凋亡(Apoptosis Analysis)
细胞凋亡是一种细胞程序性死亡的组织生理过程,表现为细胞膜外翻、细胞质起泡及染色体的断裂和浓缩,主要发生在细胞分化(如胚胎发生),自体调节,细胞损伤响应(如病毒感染,DNA损伤)等重要生理过程,是细胞生物学的重要研究领域。目前,利用流式细胞术可以检测的细胞凋亡标志主要有Annexin V,TUNEL,Caspase等。ImageStream可以检测所有这些凋亡标记,而与传统流式检测相比,其具有两方面独特的优势:一是能够区分假阳性和假阴性,二是能准确区分凋亡和坏死。
细胞凋亡检测过程中,常常会遇到假阳性和假阴性的情况。假阳性一般是由于正常细胞上黏附了凋亡小体,从而在流式检测时误认为是阳性。如图十七所示的情况,一些正常细胞表面附着了TUNEL阳性碎片,从而显示TUNEL阳性。对于这种情况,可以利用IDEAS软件中的Delta Centroid参数来区分真假阳性(图17. )。
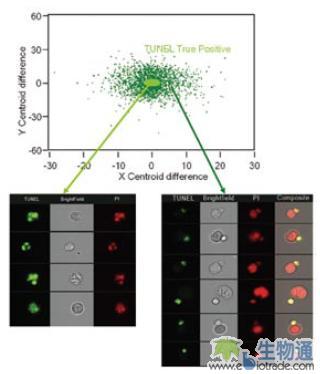
类似的情况也同样出现在Annexin V和Caspase检测中,凋亡小体会附着在正常细胞表明,造成假阳性,而一些已经出现了染色体断裂和浓缩的凋亡细胞却是Annexin V或Caspase阴性的,从而造成假阴性结果。由于ImageStream能够获得细胞图像,并对图像进行分析,因此可以排除这些假阳性和假阴性结果。
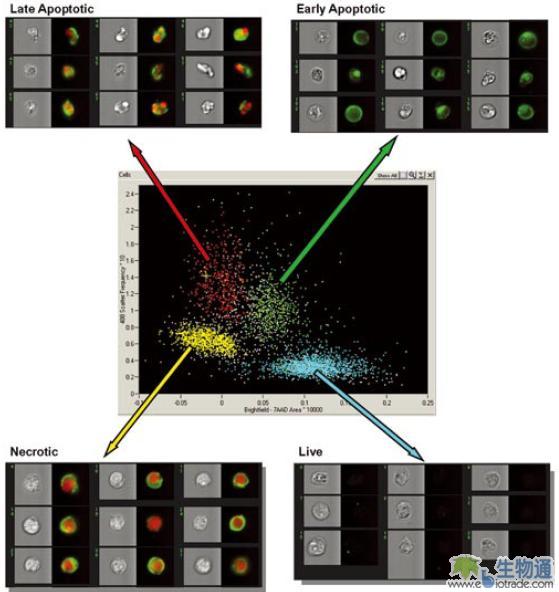
大多数的利用流式细胞术检测凋亡的方法,比如Annexin V法,都很难区分晚期凋亡和坏死细胞,因为这两类细胞都表现为凋亡标记和细胞核染料的双阳性。但这两种细胞在细胞核形态上存在明显区别:晚期凋亡细胞由于染色体的断裂和浓缩,细胞核不完整,而是塌缩为几个小的区域,相反坏死细胞的细胞核很完整。根据这个特征,ImageStream可以通过对细胞核形态进行分析,清晰的区分细胞凋亡的不同阶段,区分晚期凋亡和坏死细胞(图18)。
8. 细胞周期分析(Cell Cycle Analysis)
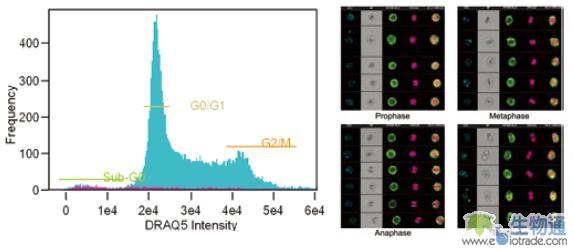
使用细胞核染料进行细胞染色,然后利用流式细胞仪检测,这是细胞周期分析的常用方法,但这种方法不能区分有丝分裂的不同阶段。传统的有丝分裂细胞分析方法是显微镜下观察,但有丝分裂细胞数量很少,肉眼进行观察和统计,效率低下且很难保证准确性。ImageStream可以将细胞周期分析和有丝分裂细胞分析结合起来。如图19所示,研究人员利用ImageStream对40000个HL60细胞进行细胞周期检测,然后进一步在其中找到了392个处于有丝分裂状态的细胞,并将这些细胞区分为有丝分裂前期、中期、后期及末期等不同阶段。
9. 白细胞亚群分析(Cell Classification)
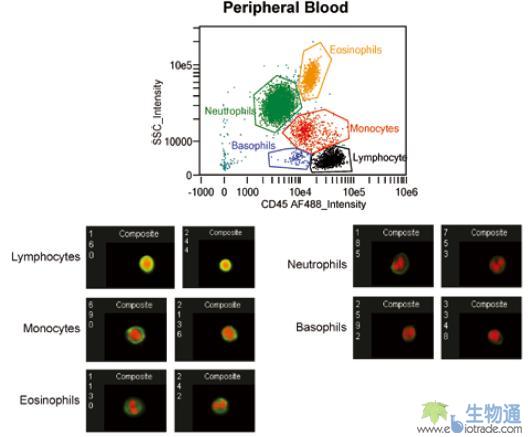
白细胞亚群分析是流式细胞术最常见的应用之一,利用ImageStream进行细胞分群,不仅可以获得每个亚群的统计数据,还能直观的看到细胞图像(图20)。
二、分选微型模式生物
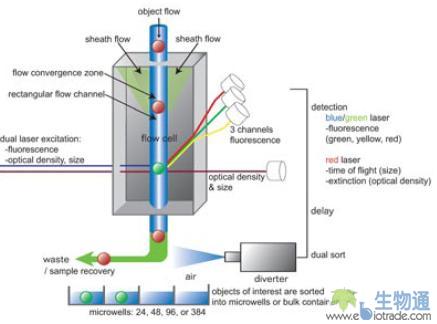
微型模式动物、模式植物种子、大体积细胞及微球的分选在生命科学研究中有着非常广泛的应用,但是由于这些对象体积太大,普通流式细胞仪难以对其进行分选,而手工镜下分选耗时耗力,效率底下,准确性难以保证,因此美国Union Biometrica公司的COPAS生物分选系统应运而生。COPAS系统是目前市面上唯一的能够分选20-1500μm生物微粒的全自动、高通量分选系统,可以检测微粒的尺寸、光密度及荧光信号,并根据用户设定的域值,将相应的微粒喷入96孔板或其它容器中,整个过程对于微粒的生物活性不会产生任何负面影响。
COPAS技术平台是基于流式细胞技术开发的,但它与普通流式细胞技术相比,做了两个重要的改进以适应大体积生物微粒分析与分选的需要。
第一,系统管路直径增大以适应20-1500μm大小的生物微粒,这比普通流式细胞仪用于分选单个真核细胞的管路大的多。每一个COPAS系统都针对不同尺寸范围的微粒进行管路的优化设计,以便在高速高通量分选时获得最好的检测灵敏度与准确性。
第二,专利的气流分选装置—COPAS技术的核心,那就是(图21)。当不需要收集分选微粒时,分选系统会通过气体将液流吹入废液槽中;当需要分选的微粒经过时,分选系统会暂时将气体分流器关闭,使气流中断,然后再重新打开分流器,这样就能将含有待选微粒的液流喷入微孔板或收集容器中。这种分选的方式非常温和,可以保证收集到的生物活体或敏感化学物质的活性和完整性,对于后续的培养和分析不会产生任何负面影响,而普通流式细胞仪一般采用电磁场进行分选,会对生物活体产生致命的影响。
COPAS生物分选系统被广泛应用在模式动植物研究、大体积细胞研究及药物筛选等方面,具体应用对像包括微型模式动物:C. elegans、D. melanogaster、Zebrafish、Medaka、Mosquito、Xenopus;模式植物种子与花粉:Arabidopsis、花粉;大体积细胞与细胞簇:胚胎干细胞、胰岛;微球/颗粒:化合物结合微球、微球分析。仅仅统计COPAS在线虫分选方面的应用,就在Nature系列杂志上发表了7篇以上的文献。COPAS系统可以根据死活、不同生长时期及荧光信号强弱来分选线虫,下面是COPAS分选线虫的两个简单实例。
1) 根据线虫大小(TOF)和光密度(EXT)两个参数,对不同生长时期的线虫进行分选和分析
2)利用荧光信号(FLU)参数,分选转基因线虫
三 、高通量分析
随着生命科学领域的研究者对于自动化检测和高通量筛查提出了越来越高的要求,能够自动进行高通量检测的流式细胞系统也应运而生。专业流式细胞仪生产厂家BD开发的FACSArray 生物分析仪就是一个典型的例子。FACSArray系统外形简洁,操作简便,其光学系统配置了532nm绿色激光器和635nm红色激光器,可以检测2个散色光信号和4个荧光参数。由于整合了96孔板上样技术和数字化电子系统,使得样本采集的速度达到15000个/秒,尤其适用于高通量筛选。FACSArray 生物分析仪不仅可以应用于传统的流式细胞分析领域,而且还可以和BD公司开发的CBA技术(Cytometric BeadArray)结合,用于多重蛋白检测,为高通量流式分析创造了一个新的标准平台。
综上所述,随着现代科技的发展,流式细胞技术已经在检测技术、分选技术及高通量分析方面取得了重大突破,将会为生命科学领域的进步作出更大的贡献
|