注册登录才能更好的浏览或提问。
您需要 登录 才可以下载或查看,没有账号?立即注册
×
——邢文革
酸检测技术(Nucleic acid testing, NAT)是一种新兴的血液传染病检测方法。研究表明, 采用NAT可缩短HBV、HCV和HIV感染的 “窗口期”,还可以检出因病毒变异、免疫沉默性感染等原因而漏检的污染血液。因此,NAT作为新增的血液筛查技术已经成为发达国家和部分发展中国家献血者传染病筛查的常规项目。我国尚未作为常规的检测手段,但已有一些单位做了有益的研究和评估工作。
1. NAT开展现状
1.1 国外血站NAT开展现状
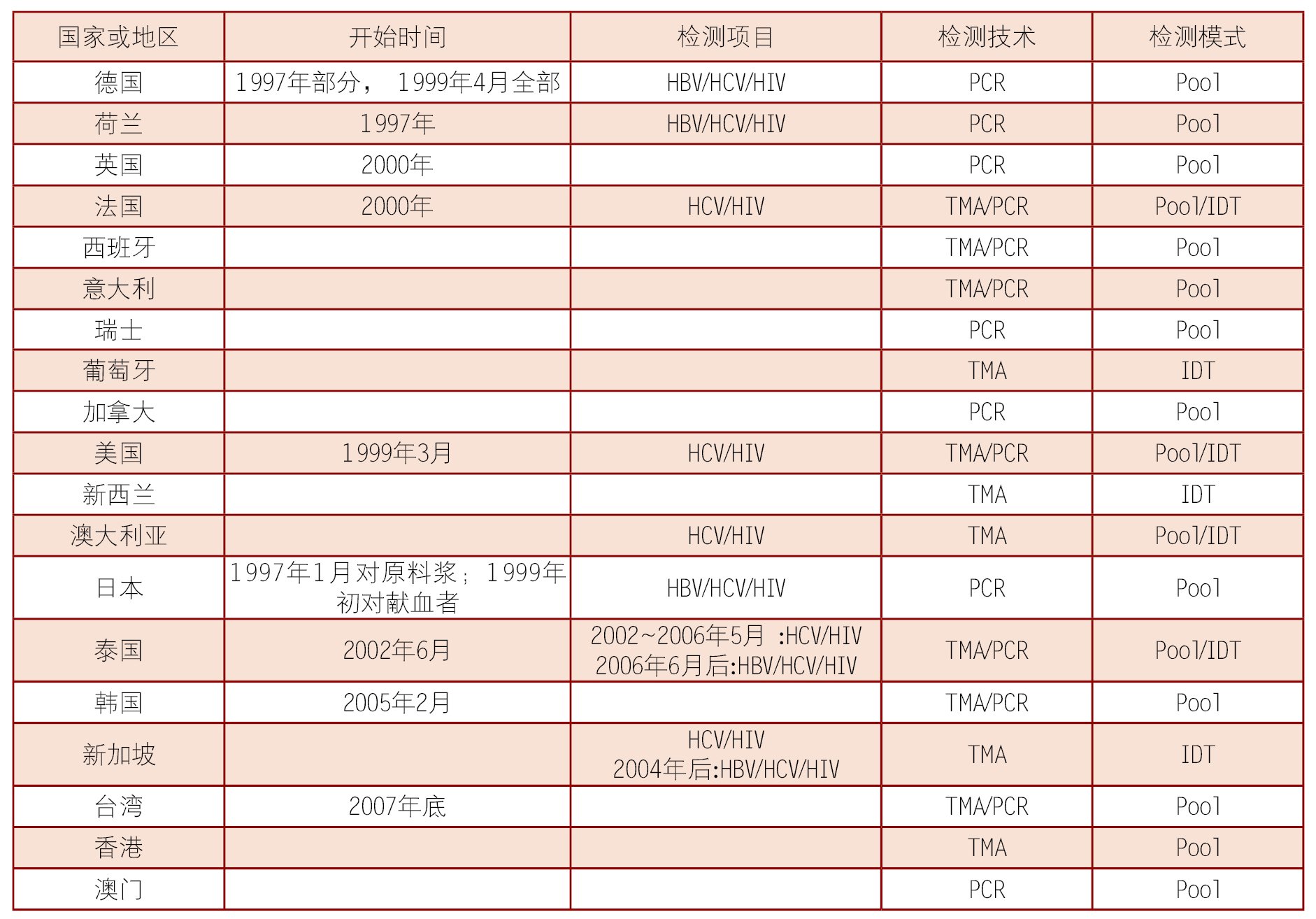
表1是已开展NAT检测的部分国家和地区及其所用技术。日本是世界上最早在全国范围内对血液进行HBV、HCV、HIV NAT筛检的国家;德国和荷兰从1997年起开始NAT筛检的尝试;美国则从1999年3月开始在FDA新药审核程序下使用不同的试剂进行常规血液筛检。
表1 开展NAT检测的国家(地区)及所用技术
1.2 国外血站NAT检测结果
表2为各国公布的献血者的NAT检出结果汇总,主要进行的是HIV和HCV两项检测。
表2 国外献血者NAT检测结果
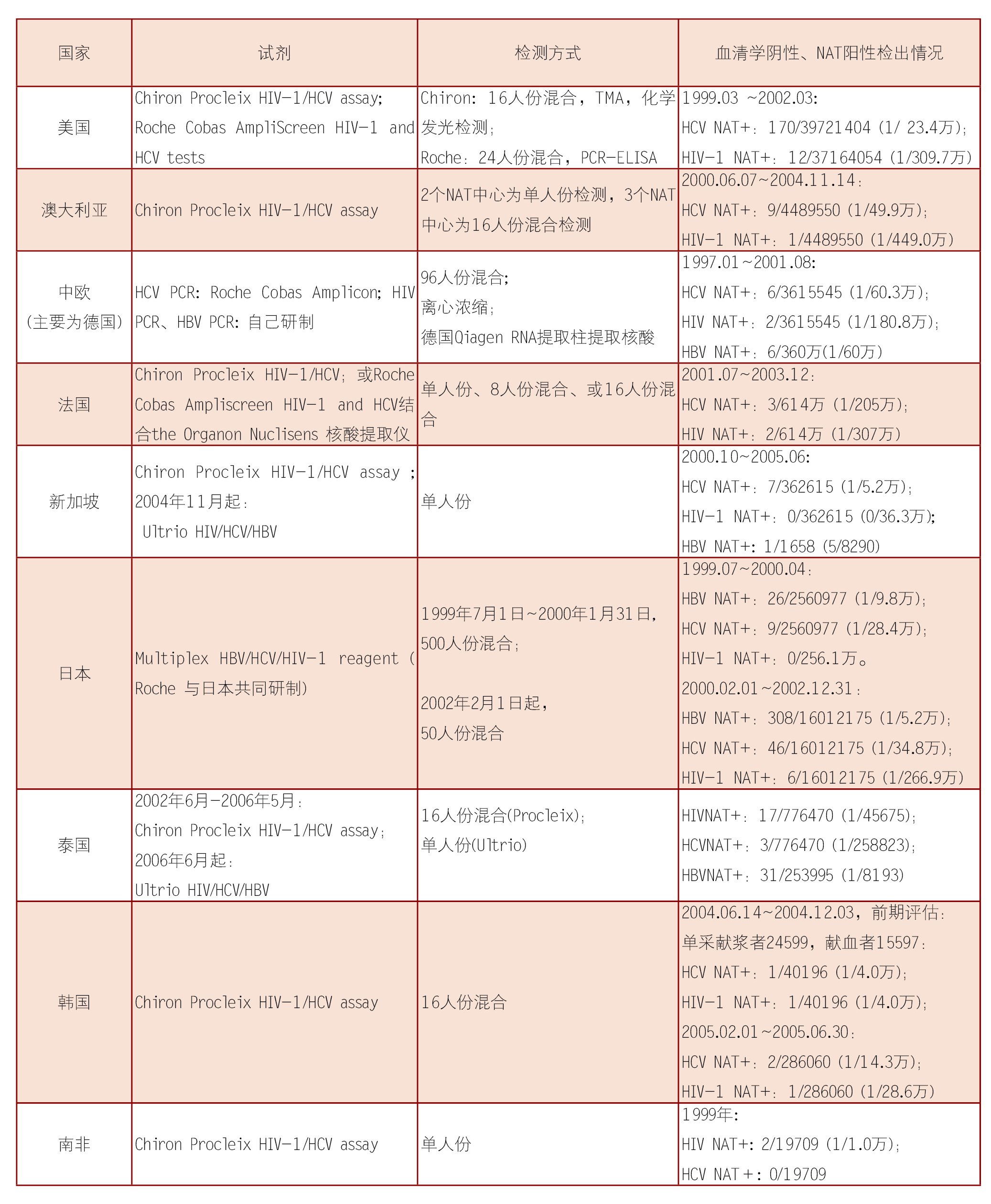
表中可以看出,尽管发达国家的血液安全水平已经大幅度提高,但是由于EIA“窗口期”等原因所致的漏检概率仍然有几百万分之一到几万分之一。
研究表明,混合血样NAT检测(当灵敏度达到对病毒含量为1000copies/ml的标本进行混合样本检测的检出率为95%时)可将HBsAg、抗-HCV、抗-HIV ELISA检测的平均“窗口期” 缩短约9d、59d和11d,单人份NAT检测(当灵敏度达到对病毒含量为50copies/ml的标本的检出率为95%时)可将HBsAg、抗-HCV、抗-HIV ELISA检测的平均“窗口期” 缩短约25d、60d和12d。
1.3 国内血站NAT研究状况
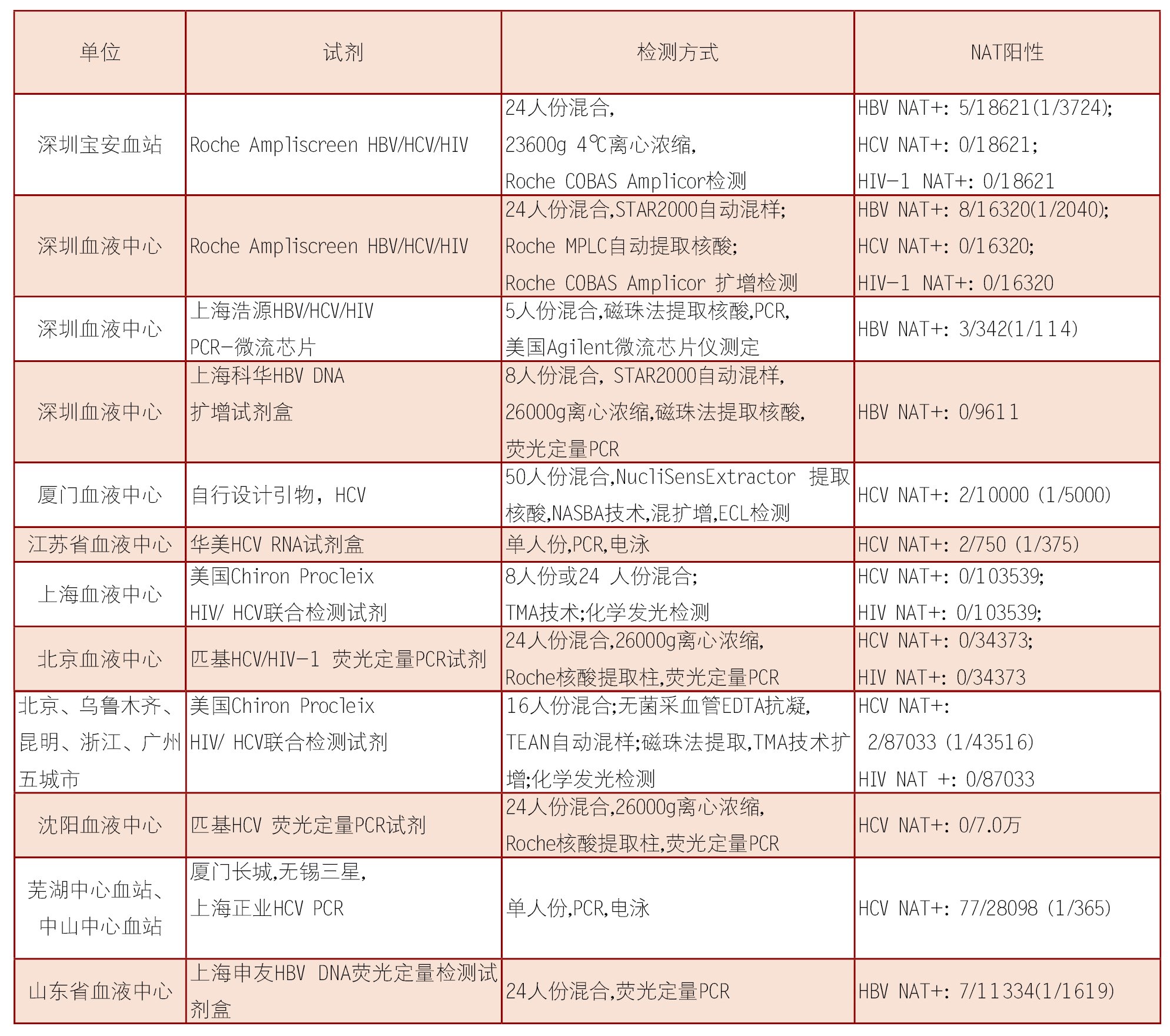
表3为我国献血者NAT研究状况总结。
我国为HBV高流行区,深圳HBV NAT+检出率为1/114(5人份混合,国产试剂)~1/3724(24人份混合),济南为1/1619(24人份混合,国产试剂),我国香港地区为1/2599(采用Roche S201 MPX 6人份混合检测以及Chiron Procleix Ultrio单人份检测),北京血液中心于2007年9月~2008年3月,用Roche COBAS S201 MPX System检测系统进行了20378份北京地区合格血液HBV/HCV/HIV三项联合NAT检测,主要为6人份混合检测,少量为单检,共检出NAT+血液14份(1/1433),目前已对其中的6份NAT+血液进行鉴别,4份鉴别为HBV NAT+。以上数据表明,我国如果开展NAT筛查,应做HBV NAT。
我国献血者血液HCV NAT检出率结果差异很大,从1/365 (国产试剂,单人份,电泳,安徽,有偿献血者)、1/4.4万(进口Chiron试剂,16人份混合,五城市)、到0/10.4万(进口Chiron试剂,16人份混合,上海)。这些差别的原因,既与献血人群、所用抗-HCV筛查试剂的质量有关,也与所用的NAT检测方法有关。传统的PCR扩增电泳检测的方式为开放式,很容易造成实验室内的交叉污染,造成假阳性结果,不适合作为献血者的NAT检测方法。
关于HIV NAT的研究数据较少,在上述北京、上海、深圳4个研究报道中,总计检测24.2 万合格献血者,未检出HIV NAT+,即HIV NAT检出率为0/24.2万,需要进一步扩大检测样本量才能得到具体的HIV NAT检出率。
应用不同的NAT检测体系,HBV NAT+检出率结果差异较大,有高达1/114(5人份混合)、有低至0/9611(8人份混合),两份研究报告均来自深圳血液中心,地域差异、研究时间段的不同等因素不可能造成如此大的差异,推测主要是NAT检测系统的差异所造成。由此可见,在开展NAT检测之前,必须对NAT检测系统进行必要的考察和质量评估,特别是HBV NAT的分析灵敏度。
表3 国内血站NAT研究状况
1.4 我国原料浆NAT研究结果
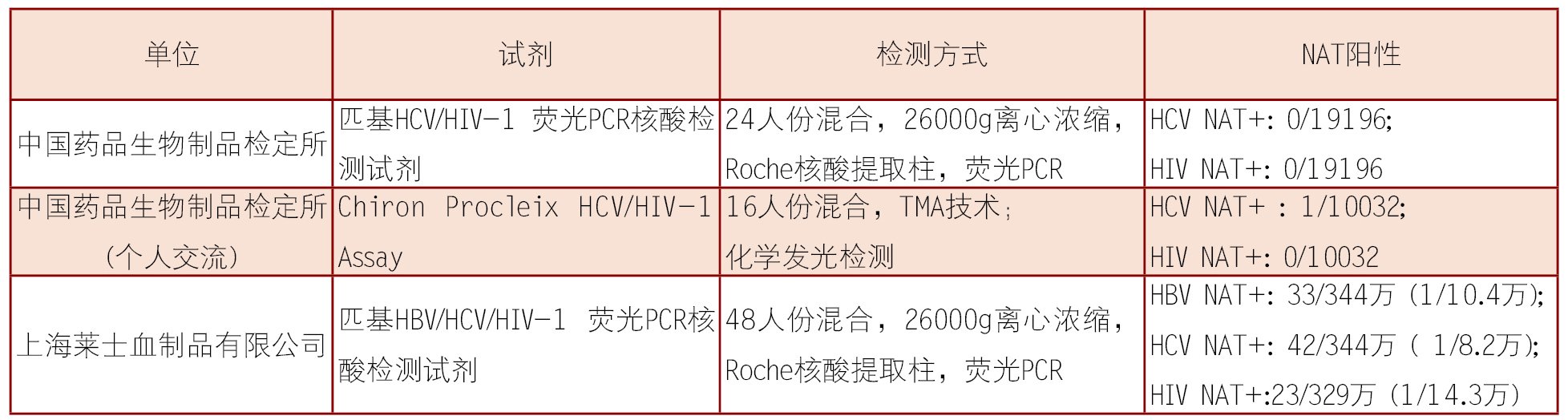
有关我国原料浆核酸检测的报道较少,见表4。上海莱士血制品公司从2001年起对原料血浆进行HBV/HCV/HIV核酸检测,48人份混合检测,2001年至2007年4月共检测出HCV RNA阳性血浆42袋( 1/8.2万), HBV DNA阳性血浆33袋(1/10.4万), HIV RNA阳性血浆23袋(1/14.3万) 。我国原料浆中HBV DNA阳性检出率(1/10.4万)较献血者中低,笔者认为主要原因是混合样本数较大以及所用HBV NAT试剂本身的灵敏度有待提高所致。随着NAT试剂质量的不断提高和样本混合数的逐渐减少,将更能发挥核酸检测的作用。
表4 国内原料浆NAT检测情况
2. 血清学与NAT实验要求比较
2.1 标本要求
血清学技术可直接对血清、血浆进行检测,且抗原/抗体在标本中稳定存在,标本不需特殊处理。
NAT一般需先提取病毒核酸,传统的酚-氯仿提取方法繁杂,费时长,且易造成污染。近年来,采用具有吸附核酸特性的玻璃粉、二氧化硅、硅藻等提取核酸,简化了步骤,提高了提取效率。现在已有多家公司设计了自动化提取核酸的仪器,使核酸提取更加规范、简便,可同时处理大批的标本,提取的核酸质量也可得到保障。HBV DNA、HIV RNA可在血液标本中稳定存在。HCV RNA稳定性差,易降解,故应尽快进行核酸的分离提纯以保证结果的可靠性。核酸可在低温(-20℃以下)长期保存,应将核酸标本贮存于低温。
2.2 试剂要求
血清学技术经过多年的发展,敏感性特异性均有了很大提高,使用经国家技术监督机构认可的商品化试剂进行检测,检测结果的质量可得到保证。但因病毒感染后,抗体的产生需一段较长时间存在“窗口期”,这一期间的感染者易发生漏检;且在一些免疫反应低下的人中,抗体产生受到抑制,或感染了变异株,以及病毒在体内发生变异导致抗原性改变等情况,都会造成漏检。受敏感性限制,一些血清学阴性的人也存在低水平的病毒核酸,足以引起病毒的传播。此外,由于抗体存在交叉反应,许多未感染者也会被误诊为阳性。
分子生物学技术可根据已知序列,设计病毒特异性引物、探针,并且可根据已发现的变异株的序列设计引物探针,保证已被发现的病毒株均可被检出。分子生物学技术敏感性高,标本中极微量的核酸也可被检出,理论上,只要样本有一个病原体存在,PCR就可以检测到,一般实验室也能检出10-102基因拷贝,而目前病原体检测方法一般需要105-107个病原体才可检测到,能更有效地控制病毒的传播。PCR技术可在病毒感染后数天甚至数小时内检出病毒核酸,有效地避免了“窗口期”感染。分子生物学技术正逐渐规范化,各种商品化的试剂盒已在欧美等一些国家完成或进入临床实验阶段,部分厂家的产品已得到认可,并开始推广应用。FDA评判NAT试剂能否用于血液筛查的标准之一是必须对病毒含量50copies/ml的单个标本检出率>95%且特异性99%以上;对混合样本分析灵敏度是100copies/ml,而其中的原始供血样本是5000 copies/ml。
2.3 设备要求
现在有与血清学技术配套的自动化酶标系统,可实现血清学检测的完全自动化,简化了操作程序,保证了质量。
分子生物学技术目前也在向自动化操作方向发展,目前已有自动提取纯化核酸的仪器,自动完成热循环、检测的仪器,且分子生物学技术也逐渐以微孔板作为载体进行反应,使自动化的酶标系统也可用于分子生物学的检测。存在问题是,自动化仪器同期处理标本量较小,使这一方法的推广使用受到限制,但随着技术的革新与改造,这一问题也将得到解决。
2.4 实验室管理
酸检测对实验室条件的要求较高,需要规范化场所和高素质的操作人员。还必须建立完善的检测程序,样本的制备、检测流程需要有防污染措施,对整个反应系统进行内外质控。
3.成本效益
血清学技术费用较低,宜于推广。分子生物学技术成本较高,限制了其应用,目前,国外采用混合法检测技术,降低了单份标本的检测成本。随着应用的推广及商品化程度的提高,分子生物学技术的检测成本也将会大幅降低。
美国学者的研究报道,在血清学筛查基础上增加微量混合样本和单个供者样本的HBV、HCV和HIV-1的NAT筛查,应用决策分析模型评估费用、健康和成本效益。与血清学筛查比较,增加微量混合样本的NAT筛查分别能避免37例HBV、128例HCV和8例HIV感染,能增加53寿命年和102质量调整寿命年(quality adjusted life—year,QALY),但净增费用1.54亿美元。
还有一项研究采用Markov决策模型分析NAT筛查全血样本中HIV、HCV、HBV的成本效益,美国每年NAT筛查HIV和HCV的费用为1.55亿(微量混合样本)~4.28亿美元(单个供者样本),可以避免4—7例HIV感染和56—59例HCV感染。加上NAT筛查HBV,每年增加的费用是0.39亿-1.3亿美元,可以避免9—37例HBV感染。因此,在每增加一个QALY的NAT筛查费用是470万-1120万美元。由此可见,增加NAT筛查虽然提高了输血安全性,但其成本、效益比较低,超过了通常的医疗保健费用范围。因此,还应努力降低NAT检测费用,以增加决策者对NAT用于血液筛查的信心,提高其在医疗实践中的可接受性。
4.检测规范
1999年12月,FDA颁布了一项针对HIV NAT试剂的指南《检测1型和2型HIV核酸序列的体外检测试剂的制造和临床评价》。
1999年12月,FDA颁布了《对血浆供者混合样本采用核酸检测以充分和适当降低HIV-1和HCV的传播风险(草案)》。
2002年3月,FDA颁布了第三个关于NAT用于血液筛查的指南《对全血或血液成分供者的混合和单个样本进行核酸检测以充分和适当降低HIV—l和HCV的传播风险(草案)》。
2004年10月,FDA颁布了第四个有关指南《对全血或血液成分(包括原料血浆和原料白细胞)供者的混合和单个样本进行核酸检测以充分和适当降低HIV-1和HCV的传播风险》替代了2002年草案而成为正式指南。FDA强制要求此指南发布后6个月,血液制品生产企业和血液中心进行NAT全血和血液成分HIV一1和HCV筛查T作,并对在何种条件下采用NAT以及检测的方法和结果处理作了推荐。对于采用NAT筛查的血液制品或者血液,需在说明书中进行标注。
2005年7月,FDA颁布了第五个有关指南草案《HIV-1和HCV的核酸检测:检测、产品处理以及供者的延迟供血和再供血》指南中提到,美国进行的大规模研究表明,NAT试剂使用以后,估计全血和血液成分中残留的HIV一1和HCV的感染风险已经分别降至大约1:213.5万和1:193.5万。该指南不允许使用NAT检测阳性的血液/血液制品,一旦NAT检出混合样本阳性,要找出其中阳性的个体样本,还要通知供者推迟供血,并对该供者的既往情况进行回顾性调查。该指南还对如何分析NAT检测结果以及对NAT检测阳性的血液和供者的处置提出建议。 |